|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
a. Basis-Ionen I
Autoprotolyse
Säuregrad
Im flüssigen Zustand dissoziiert das Wasser, die Moleküle brechen auf und teilen sich in Ionen ("Autoprotolyse"):
Ein H-Atom spaltet sich ab, lässt aber das Elektron e- zurück, so dass es nun nicht mehr elektrisch neutral ist, sondern aufgrund der fehlenden Ausgleichsladung nun das positiv geladenes Kation H+ geworden ist.
Das zurückgebliebene Hydroxid HO- ist wegen des überzähligen e- ein negativ geladenenes Anion
Da das H-Atom nun das einzelne Elektron e- verloren hat, besteht das Wasserstoff-Ion nur noch aus einem einzelnen Proton p+
Nun schwirren nicht alle Protonen p+ frei herum, sie verbinden sich sprunghaft und wechselnd mit Hydroxyd-Ionen HO-
auch diese verbinden sich, bilden Ringe und zerfallen immer wieder. So sind die meisten Protonen wechselnd angekoppelt; frei aktiv sind - im idealen Wasser in gleicher Anzahl, aber unterschiedlicher Masse -
Zur Vereinfachung - ohne die Vorgänge zu verfälschen - vergessen wir einfach H3O+ und H2O und geben vor, unser Ionen-Geschwirre bestehe in reinem Zustand aus Hydoxid-Anionen HO- und Protonen p+.
wobei pH = 14 (Minimum) bis pH = 0 (Maximum)
Die H-Konzentration liegt zwischen pH = 14 (Minimum) und pH = 0 (Maximum),
wobei pHO = 0 (Minimum) bis pHO = 14 (Maximum)
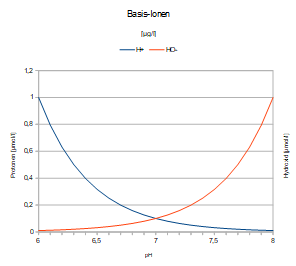
Zumeist wird nur der gegenläufige pH-Wert betrachtet:
Niedrigerer pH-Wert beschreibt
höhere (!) Protonen-Konzentration – in 10er-Potenz-Schritten,
niedrigere Hydroxid-Konzentration – in 10er-Potenz-Schritten
höherer pH-Wert beschreibt
niedrigere (!) Protonen-Konzentration – in 10er-Potenz-Schritten,
höhere Hydroxid-Konzentration – in 10er-Potenz-Schritten,
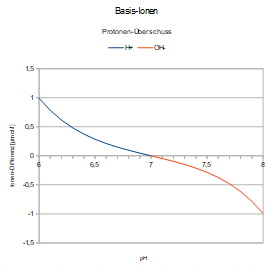
pH = 7: Ionen ausgeglichen, Reaktion neutral.
pH < 7: Protonen-Überschuss, Reaktion sauer
pH << 7: starker Protonen-Überschuss, Reaktion aggressiv sauer.
pH > 7: Protonen-Mangel, Reaktion alkalisch.
pH >> 7: starker Protonen-Mangel, Reaktion aggressiv alkalisch.
pH = 6 die 10-fache Protonen-Konzentration, pH = 5 die 100-fache, pH = 4 die 1000-fache.
pH = 8 die 0,1-fache Protonen-Konzentration, pH = 9 die 0,01-fache, pH = 10 die 0,001-fache.




1. ANORGANISCHE ASPEKTE
a. Basis-Ionen I
Autoprotolyse
Säuregrad
Autoprotolyse
Das kleinste Bauteil des Wassers, das Wasser-Molekül H2O, welches den Stoff "Wasser" ausmacht, ist eine Verknüpfung von - einem Atom "Sauerstoff O" mit der Masse 16 - zwei Atomen "Wasserstoff H" mit der Masse je 1
Wasser hat also die Masse 18, die Masseneinheit ist für uns nicht von Bedeutung. | Das Wasserstoff-Atom H besteht aus - einem positiv geladenen Proton p+ im Kern - einem (!) negativ geladenen Elektron e- in der Hülle
Da beide Ladungen zwar entgegengesetzt sind (sich also gegenseitig anziehen, was die Bindung bewirkt), aber gleich groß, ist das Atom elektrisch neutral. |
Im flüssigen Zustand dissoziiert das Wasser, die Moleküle brechen auf und teilen sich in Ionen ("Autoprotolyse"):
Ein H-Atom spaltet sich ab, lässt aber das Elektron e- zurück, so dass es nun nicht mehr elektrisch neutral ist, sondern aufgrund der fehlenden Ausgleichsladung nun das positiv geladenes Kation H+ geworden ist.
Das zurückgebliebene Hydroxid HO- ist wegen des überzähligen e- ein negativ geladenenes Anion
H2O = HO- + H+
Da das H-Atom nun das einzelne Elektron e- verloren hat, besteht das Wasserstoff-Ion nur noch aus einem einzelnen Proton p+
H+ = p+


Nun schwirren nicht alle Protonen p+ frei herum, sie verbinden sich sprunghaft und wechselnd mit Hydroxyd-Ionen HO-
zu zusammengeballten Kationen "Hydroxonium H3O+"
H2O + p+ = H2OH+ = H3O+
zu elektrisch ungeladenen Wassermolekülen H2O
HO- + p+ = HO- + H+ = H2O
auch diese verbinden sich, bilden Ringe und zerfallen immer wieder. So sind die meisten Protonen wechselnd angekoppelt; frei aktiv sind - im idealen Wasser in gleicher Anzahl, aber unterschiedlicher Masse -
die Wasserstoff-Kationen H+ mit 1/10ˆ7 [gr/l]
die Hydroxid-Anionen HO- mit 17/10ˆ7 [gr/l]
Zur Vereinfachung - ohne die Vorgänge zu verfälschen - vergessen wir einfach H3O+ und H2O und geben vor, unser Ionen-Geschwirre bestehe in reinem Zustand aus Hydoxid-Anionen HO- und Protonen p+.
Ich
nenne diese Ionen "Basis-Ionen", ihre Anzahl ist gleich, so dass das
Wasser elektrisch neutral ist. Im natürlichen Wasser schwirren aber
noch viele andere Ionen herum, die in späteren Kapiteln behandelt
werden.


Säuregrad
Ein (Un-)Gleichgewicht der Basis-Ionen - aus welchen Gründen auch immer - ist die Ursache für das, was landläufig (wieder nicht ganz korrekt) als Säuregrad bezeichnet wird. In dem bisher angenommenen Fall reinen Wassers sind HO- und p+ in identischer Ladungs-Konzentration, das Wasser ist neutral, hat keine besonderen Eigenschaften.
Wieder einmal vereinfacht: Die Ionen-Konzentrationen beschreiben wir mit zwei dimensionslosen Zahlen,


Säuregrad
Ein (Un-)Gleichgewicht der Basis-Ionen - aus welchen Gründen auch immer - ist die Ursache für das, was landläufig (wieder nicht ganz korrekt) als Säuregrad bezeichnet wird. In dem bisher angenommenen Fall reinen Wassers sind HO- und p+ in identischer Ladungs-Konzentration, das Wasser ist neutral, hat keine besonderen Eigenschaften.
Wieder einmal vereinfacht: Die Ionen-Konzentrationen beschreiben wir mit zwei dimensionslosen Zahlen,
dem
pH-Wert für die Protonen-Konzentration Kz(H+) =
1/10ˆpH [gr/l] > pH = -lg[Kz(H+)]
dem pHO-Wert für die Hydroxid-Konzentration Kz(HO-) = 17/10ˆpHO [gr/l] > pHO = -lg[Kz(HO-)]
Die
Summe von pH und pHO ist 14 [die Definition ist hier nicht von Belang],
bei neutralem Wasser also pH = pHO = 7. In realem Wasser sind aber noch
andere Stoffe gelöst, so dass sich ein Ungleichgewicht einstellen wird.
Die HO-Konzentration liegt zwischen pHO = 0 (Minimum) und pHO = 14 (Maximum),wobei pH = 14 (Minimum) bis pH = 0 (Maximum)
Die H-Konzentration liegt zwischen pH = 14 (Minimum) und pH = 0 (Maximum),
wobei pHO = 0 (Minimum) bis pHO = 14 (Maximum)


Zumeist wird nur der gegenläufige pH-Wert betrachtet:
Bei pH < 7 herrscht Protonen-Überschuss, das Wasser reagiert (und schmeckt) "sauer" - je kleiner desto mehr.
Bei pH > 7 herrscht Protonen-Mangel, das Wasser reagiert "alkalisch", "basisch" - je größer, desto mehr.
Je weiter die Werte entfernt sind vom Neutralpunkt pH = pHO = 7, desto aggressiver reagiert die Flüssigkeit.
Bei pH > 7 herrscht Protonen-Mangel, das Wasser reagiert "alkalisch", "basisch" - je größer, desto mehr.
Je weiter die Werte entfernt sind vom Neutralpunkt pH = pHO = 7, desto aggressiver reagiert die Flüssigkeit.
Niedrigerer pH-Wert beschreibt
höhere (!) Protonen-Konzentration – in 10er-Potenz-Schritten,
niedrigere Hydroxid-Konzentration – in 10er-Potenz-Schritten
höherer pH-Wert beschreibt
niedrigere (!) Protonen-Konzentration – in 10er-Potenz-Schritten,
höhere Hydroxid-Konzentration – in 10er-Potenz-Schritten,
Noch einmal:
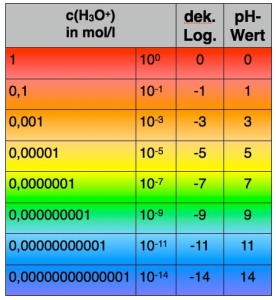
Der pH-Wert gibt die Protonen-Konzentration absteigend an im Bereich von 0 bis
14, der Neutralpunkt ist 7.pH = 7: Ionen ausgeglichen, Reaktion neutral.
pH < 7: Protonen-Überschuss, Reaktion sauer
pH << 7: starker Protonen-Überschuss, Reaktion aggressiv sauer.
pH > 7: Protonen-Mangel, Reaktion alkalisch.
pH >> 7: starker Protonen-Mangel, Reaktion aggressiv alkalisch.

Da die Werte dekadisch-logarithmisch definiert sind, bedeutet
gegenüber pH = 7pH = 6 die 10-fache Protonen-Konzentration, pH = 5 die 100-fache, pH = 4 die 1000-fache.
pH = 8 die 0,1-fache Protonen-Konzentration, pH = 9 die 0,01-fache, pH = 10 die 0,001-fache.



Die Steuerung
der Protonen-Hydroxit-Relation wird erst später besprochen werden, aber
das Vorgehen ist jetzt schon klar:
Man senkt den pH-Wert, indem man
Protonen hinzufügt bzw freisetzt
oder
Hydroxid bindet
Man erhöht den pH-Wert, indem man
Hydroxit hinzufügt bzw freisetzt
oder
Protonen bindet


Neumünster, 11.12.2022 *
Egbert W Gerlich *
egbert@ew-gerlich.de