|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
a. Basis-Ionen II
Auswirkungen
Auswirkungen

1. ANORGANISCHE ASPEKTE
a. Basis-Ionen II
Auswirkungen
Auswirkungen
Die
Protonen-Konzentration, gemessen als pH-Wert des Säuregrades, hat
enorme Auswirkungen auf nahezu alle Abläufe im Wasser - sowohl
chemische als auch biologische.
Einige Aspekte sollen als zunächt Beispiele dienen, sie werden später noch behandelt:
Einige Aspekte sollen als zunächt Beispiele dienen, sie werden später noch behandelt:
1. Protein-Abbau
Beim Abbau von Proteinen und bei der Verrottung abgestorbener Biomasse, also bei Ausscheidungen und Verwesung von Pflanzen und Tieren, wird die Stickstoffverbindung "Ammonium NH4+" freigesetzt. Das Ammonium-Molekül besteht aus einem Stickstoff- und vier Wasserstoff-Atomen, verfügt aber in der Elektronenhülle nur über zehn statt elf Elelektronen, weshalb das Ammonium-Molekül durch die Überzahl der (7+4) Protonen positiv geladen ist, also als Kation bezeichnet werden kann. Noch deutlicher dargestellt werden kann dies als ein Molekül aus einem Stickstoff- und drei Wasserstoff-Atomen, dem ein Proton angebunden ist:
Bei Protonen-Überschuss, also in saurem Wasser (pH<7), ist Ammonium hinlänglich stabil und wird von Pflanzen aufgenommen oder von Mikro-Organismen zu anderen N-Verbindungen umgewandelt.
Bei Protonen-Mangel hingegen, also in alkalischem Wasser (pH>7), trennt sich das Proton p+ ab und verbindet sich mit einem Hydroxid-Ion HO-:
NH3 nur im alkalischen Milieu
Die Dissoziation von Ammonium zu Ammoniak und umgekehrt ist vom pH-Wert abhängig.
Beim Protein-Abbau werden weitere Stickstoff-Verbindungen frei, so die Nitrit- und Nitrat-Ionen, NO2- und NO3-. Der weitere Umbau ist später zu erläutern, hier aber ist der Einfluss des Säuregrades festzuhalten:
Ein zwar kleiner, aber beachtenswerter Teil des Nitrits fängt nämlich gerade bei Protonen-Überschuss ein p+ ein und bildet das gefährliche HNO2-Molekül der Salpetrigen Säure.
Bei höheren pH-Werten führt erst eine weit höhere Nitrit-Konzentration zu grenzwertiger HNO2-Bildung:
Bei pH = 6,5 genügen weniger als ein 1 [mg/l], um kritsche 0,5 [µg/l] HNO2 zu bilden, bei pH = 7,5 bedarf es ein Vielfaches.

HNO2 vorwiegend im sauren Milieu
War bei der Ammoniak-Vermeidung saures Wasser von Vorteil, ist es bei Vermeidung der Salpetrigen Säure von Nachteil.
2. Eisen
Von den vielen Eisenverbindungen wird das zwei-wertige Eisen-Ion Fe ++ im Stoffwechsel von Tieren und Pflanzen benötigt, das drei-wertige Fe+++ ist nicht brauchbar. Wieder spielt der pH-Wert eine große Rolle - zusammen mit dem Oxidationspotential des Sauerstoff, worauf später noch einzugehen ist. Hier schon einmal die Darstellung, in welchem Säuregrad das notwendige Fe++ überhaupt hinlänglich stabil bleibt und nicht in andere Verbindungen überführt wird.
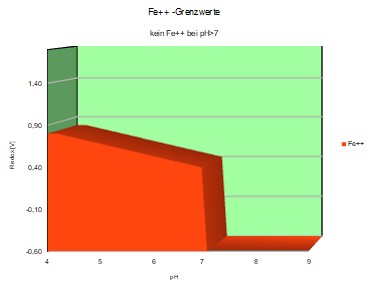
Fe++ nur im sauren Milieu
Beim Abbau von Proteinen und bei der Verrottung abgestorbener Biomasse, also bei Ausscheidungen und Verwesung von Pflanzen und Tieren, wird die Stickstoffverbindung "Ammonium NH4+" freigesetzt. Das Ammonium-Molekül besteht aus einem Stickstoff- und vier Wasserstoff-Atomen, verfügt aber in der Elektronenhülle nur über zehn statt elf Elelektronen, weshalb das Ammonium-Molekül durch die Überzahl der (7+4) Protonen positiv geladen ist, also als Kation bezeichnet werden kann. Noch deutlicher dargestellt werden kann dies als ein Molekül aus einem Stickstoff- und drei Wasserstoff-Atomen, dem ein Proton angebunden ist:
NH4+ = NH3p+
Bei Protonen-Überschuss, also in saurem Wasser (pH<7), ist Ammonium hinlänglich stabil und wird von Pflanzen aufgenommen oder von Mikro-Organismen zu anderen N-Verbindungen umgewandelt.
Bei Protonen-Mangel hingegen, also in alkalischem Wasser (pH>7), trennt sich das Proton p+ ab und verbindet sich mit einem Hydroxid-Ion HO-:
NH3p+ + OH- > NH3 + H2O
Zurück bleibt stabil das hochgiftige Ammoniak NH3 - im Wasser gelöst.
| In saurem Wasser ist die Ammoniak-Gefahr vernachlässigbar, der Ammonium-Anteil beträgt 100%. | 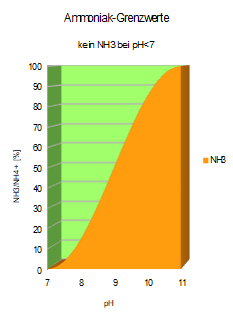 | Mit steigendem pH-Wert nimmt der Ammoniak-Anteil überlinear zu, erreicht bei pH = 9,25 bereits 50%, bei pH = 11,3 ist das gesamte Ammonium umgewandelt. |
Die Dissoziation von Ammonium zu Ammoniak und umgekehrt ist vom pH-Wert abhängig.
Beim Protein-Abbau werden weitere Stickstoff-Verbindungen frei, so die Nitrit- und Nitrat-Ionen, NO2- und NO3-. Der weitere Umbau ist später zu erläutern, hier aber ist der Einfluss des Säuregrades festzuhalten:
Ein zwar kleiner, aber beachtenswerter Teil des Nitrits fängt nämlich gerade bei Protonen-Überschuss ein p+ ein und bildet das gefährliche HNO2-Molekül der Salpetrigen Säure.
NO2- + H+ = HNO2
Bei höheren pH-Werten führt erst eine weit höhere Nitrit-Konzentration zu grenzwertiger HNO2-Bildung:
Bei pH = 6,5 genügen weniger als ein 1 [mg/l], um kritsche 0,5 [µg/l] HNO2 zu bilden, bei pH = 7,5 bedarf es ein Vielfaches.

HNO2 vorwiegend im sauren Milieu
War bei der Ammoniak-Vermeidung saures Wasser von Vorteil, ist es bei Vermeidung der Salpetrigen Säure von Nachteil.
2. Eisen
Von den vielen Eisenverbindungen wird das zwei-wertige Eisen-Ion Fe ++ im Stoffwechsel von Tieren und Pflanzen benötigt, das drei-wertige Fe+++ ist nicht brauchbar. Wieder spielt der pH-Wert eine große Rolle - zusammen mit dem Oxidationspotential des Sauerstoff, worauf später noch einzugehen ist. Hier schon einmal die Darstellung, in welchem Säuregrad das notwendige Fe++ überhaupt hinlänglich stabil bleibt und nicht in andere Verbindungen überführt wird.

Fe++ nur im sauren Milieu
3. Calcium
Zwei wichtige Ionen im realen Wasser sind Calcium- und Hydrogenkarbonat-Ionen, Ca++ und HCO3-.
Bei Protonen-Mangel, also bei alkalischem Wasser, kann sich das Proton H+ aus dem Hydrogencarbonat HCO3- verabschieden, wobei das zum Wasserstoff-Atom gehörende Elektron zurückbleibt;
das zwei-wertige Carbonat-Anion CO3-- verbindet sich mit dem ebenfalls zwei-wertigen Calcium-Kation zu Kalziumkarbonat CaCO3, das, da schwer löslich, als „Kalk“ausfällt
durch das freie Proton steigt die Protonen-Konzentration, der pH-Wert sinkt, das Wasser wird weniger alkalisch.
4. Biologie
Je stärker ein Ungleichgewicht von Protonen einerseits und Hydoxid-Ionen anderseits ist, also je weiter der pH-Wert abweicht
Der pH-Wert beeinflusst die Osmose, also die Stoffdurchdringung bei den Zellwänden aller Lebewesen. Lebende Zellen sind bei aller Toleranz eingerichtet für einen spezifischen Säuregrad.
Viele Mikro-Organismen, gerade viele Krankheitserreger, sind sehr empfindlich gegen einen Protonen-Überschuss, mögen kein saures Wasser, und das Immunsystem so mancher Fischart ist gar nicht eingestellt auf Organismen, welche nur in alkalischem Wasser überleben – daher auch die Anfälligkeit für Laich-Verpilzungen. Ebenso entspringt hieraus die Krankheitsanfälligkeit neu eingeführter, aber auch mancher altbekannter Fischarten.
Der pH-Wert des Aquarienwassers sollte also dem der Heimatgewässer zu entsprechen, denn daran haben sich die Lebewesen dieses Biotops in ihrer Entwicklung angepasst.
Auch der Stoffwechsel, also die Ernährung, wird vom pH-Wert beeinflusst - die Wirksamkeit von Enzymen, den für die bio-chemische Reaktion zwingend erforderlichen Katalysatoren, hängt vom Säuregrad ab.

Zwei wichtige Ionen im realen Wasser sind Calcium- und Hydrogenkarbonat-Ionen, Ca++ und HCO3-.
Bei Protonen-Mangel, also bei alkalischem Wasser, kann sich das Proton H+ aus dem Hydrogencarbonat HCO3- verabschieden, wobei das zum Wasserstoff-Atom gehörende Elektron zurückbleibt;
HCO3- = CO3-- + H+
das zwei-wertige Carbonat-Anion CO3-- verbindet sich mit dem ebenfalls zwei-wertigen Calcium-Kation zu Kalziumkarbonat CaCO3, das, da schwer löslich, als „Kalk“ausfällt
CO3-- + Ca++ + H+ = CaCO3 + p+
durch das freie Proton steigt die Protonen-Konzentration, der pH-Wert sinkt, das Wasser wird weniger alkalisch.
4. Biologie
Je stärker ein Ungleichgewicht von Protonen einerseits und Hydoxid-Ionen anderseits ist, also je weiter der pH-Wert abweicht
vom neutralen pH = pHO = 7
in Richtung pH = 0 (sauer)
oder pH = 14 (alkalisch),
desto reaktionsfreudiger, “aggressiver“, demnach kritischer sind die Eigenschaften des Wassers.in Richtung pH = 0 (sauer)
oder pH = 14 (alkalisch),
Der pH-Wert beeinflusst die Osmose, also die Stoffdurchdringung bei den Zellwänden aller Lebewesen. Lebende Zellen sind bei aller Toleranz eingerichtet für einen spezifischen Säuregrad.
Viele Mikro-Organismen, gerade viele Krankheitserreger, sind sehr empfindlich gegen einen Protonen-Überschuss, mögen kein saures Wasser, und das Immunsystem so mancher Fischart ist gar nicht eingestellt auf Organismen, welche nur in alkalischem Wasser überleben – daher auch die Anfälligkeit für Laich-Verpilzungen. Ebenso entspringt hieraus die Krankheitsanfälligkeit neu eingeführter, aber auch mancher altbekannter Fischarten.
Der pH-Wert des Aquarienwassers sollte also dem der Heimatgewässer zu entsprechen, denn daran haben sich die Lebewesen dieses Biotops in ihrer Entwicklung angepasst.
Auch der Stoffwechsel, also die Ernährung, wird vom pH-Wert beeinflusst - die Wirksamkeit von Enzymen, den für die bio-chemische Reaktion zwingend erforderlichen Katalysatoren, hängt vom Säuregrad ab.


Neumünster,
11.11.2022 *
Egbert W Gerlich *
egbert@ew-gerlich.de