|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
b. Haupt-Ionen I
Ionenstruktur
Ionen-Struktur
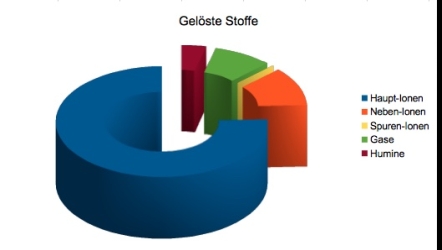
GESSNER hat feststellen können, dass sich die Massenverhältnisse der häufigsten Mineralien in Süßgewässern kaum unterscheiden (abgesehen von wenigen Ausnahmen wie die ostafrikanischen Seen oder der Rio Negro in Südamerika), dass also für Süßwasser ein Analogon des für Meerwasser von MARCET gefundenen „Prinzip der konstanten Proportionen“ existiert: „das Verhältnis der hauptsächlichen Ionen... ist... gleich“. Eingeführt in die Aquaristik hat diese Erkenntnis KRAUSE als „Standard-Ionenverhältnis“; es beschreibt die allermeisten Süßgewässer der Erde und bildet deshalb die Grundlage aller Überlegungen zu naturnahem Aquarienwasser.
Da diese Ionen eben das natürliche Süßwasser definieren, seien sie
„Haupt-Ionen“
genannt; es sind dies


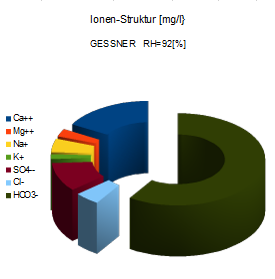
Diese Struktur nenne ich "Gessner-Struktur"
Die Hydrogen-Karbonate HCO3- stellen fast zwei Drittel der Hauptionen
Die Masse der "Erdalkali" (Ca++ und Mg++) ist dreimal so groß wie die der "Alkali" (Na+ und K+)
Die Süßwasser-Mineralisierung besteht überwiegend aus Erdalkalis und Hydrogencarbonaten
Die Süßgewässer der Welt unterscheiden sich regelmäßig nicht durch die Hauptionen-Struktur, sondern durch die Höhe der Hauptionen-Konzentration!
Die Bedeutung dieser Gessner'schen Erkenntnis, die zur Formulierung des "Gessner-Wassers" geführt hat, kann kaum überschätzt werden -
dem Überbringer H-J Krause sei gedankt!

Aber Achtung:
Die Leitungsgewässer unserer Stadtwerke entsprechen dem nicht!
Bei der Optimierung werden wir darauf zurückkommen...



1. ANORGANISCHE ASPEKTE
b. Haupt-Ionen I
Ionenstruktur
Ionen-Struktur
In
natürlichem Wasser schwirren noch viele andere Ionen herum, allerdings
in weit geringerem Maße als die Basis-Ionen H+ und HO-. Unser Wasser
hat eine Masse von hinlänglich genau 1.000 [gr/l]; davon könnten - bei
theoretisch (!) völliger Dissoziierung - etwa 55 [gr/l] den
Wasserstoff-Ionen zugeordnet werden und das 17-Fache, 945 [gr/l], den
Hydroxid-Ionen. Die Gesamtheit der weiteren Ionen bewegt sich hingegen
im sauberen Süßwasser nicht im Gramm-Bereich; im Mehrwasser hingegen
machen sie über 30 [gr/l] aus.
In einem natürlichen Süßwasser finden sich diese Ionen, die nun zu besprechen sind:
Salinität
Ozeane: 35 [g/l]
Ostsee: 8 [g/l]
Süßwasser: <1 [g/l]
Ostsee: 8 [g/l]
Süßwasser: <1 [g/l]
In einem natürlichen Süßwasser finden sich diese Ionen, die nun zu besprechen sind:

GESSNER hat feststellen können, dass sich die Massenverhältnisse der häufigsten Mineralien in Süßgewässern kaum unterscheiden (abgesehen von wenigen Ausnahmen wie die ostafrikanischen Seen oder der Rio Negro in Südamerika), dass also für Süßwasser ein Analogon des für Meerwasser von MARCET gefundenen „Prinzip der konstanten Proportionen“ existiert: „das Verhältnis der hauptsächlichen Ionen... ist... gleich“. Eingeführt in die Aquaristik hat diese Erkenntnis KRAUSE als „Standard-Ionenverhältnis“; es beschreibt die allermeisten Süßgewässer der Erde und bildet deshalb die Grundlage aller Überlegungen zu naturnahem Aquarienwasser.
Da diese Ionen eben das natürliche Süßwasser definieren, seien sie
„Haupt-Ionen“
genannt; es sind dies
| Kationen + | Calcium | Magnesium | Natrium | Kalium |
| Ca++ | Mg++ | Na+ | K+ | |
| 100 % | 64,4 % | 10,6 % | 18,4 % | 6,6 % |
| Anionen - | Sulfat | Chlorid | Hydrogencarbonat | |
| SO4-- | Cl- | HCO3- | ||
| 100 % | 13,7 % | 6,3 % | 80 % |
Die Gewissheit, dass die Anzahl der positiven Ladungen gleich der der negativen sein muss (Achtung: Die Ionen von Ca++,
Mg++ und SO4-- sind doppelt geladen!), ermöglicht es, Anionen und Kationen zusammenzuführen:
"Gessner-Wasser"
Definiert sei ein Standard-Wasser, das gerade 100 [mg/l] Kationen
enthält - es enthält 285 [mg/l] Anionen,
hat somit eine Mineralisierung ("Salinität") von 385 [mg/l]. Dieses Wasser nenne ich
hat somit eine Mineralisierung ("Salinität") von 385 [mg/l]. Dieses Wasser nenne ich
"Gessner-Wasser"
| Kationen + | Calcium | Magnesium | Natrium | Kalium |
| Ca++ | Mg++ | Na+ | K+ | |
| [mg/l] | 64,4 | 10,6 | 18,4 | 6,6 |
| 16,7 % | 2,8 % | 4,8 % | 1,7 % | |
| Anionen - | Sulfat | Chlorid | Hydrogencarbonat | |
| SO4-- | Cl- | HCO3- | ||
| [mg/l] | 39,0 | 18,0 | 228 | |
| 10,1 % | 4,7 % | 59,2 % |



Diese Struktur nenne ich "Gessner-Struktur"
Die
größten "Brocken" sind also Ca++ und HCO3-, die, würden sie nicht
dissoziieren, ein Calciumhydrogencarbonat Ca(HCO3)2 ergäben, aber
leider kommt dies nicht in fester Form vor, sondern nur gelöst. Die Gessner-Struktur bildet die Norm und den Standard für natürliches Süßwasser. Einige
Massen-Relationen sind interessant:
Die Hydrogen-Karbonate HCO3- stellen fast zwei Drittel der Hauptionen
und vier Fünftel der Anionen
Die Masse der "Erdalkali" (Ca++ und Mg++) ist dreimal so groß wie die der "Alkali" (Na+ und K+)
Ca++ und Mg++ stehen im Verhältnis 6:1,
Na+ und K+ stehen im Verhältnis 3:1
Na+ und K+ stehen im Verhältnis 3:1
Die Süßwasser-Mineralisierung besteht überwiegend aus Erdalkalis und Hydrogencarbonaten
Die Süßgewässer der Welt unterscheiden sich regelmäßig nicht durch die Hauptionen-Struktur, sondern durch die Höhe der Hauptionen-Konzentration!
Die Bedeutung dieser Gessner'schen Erkenntnis, die zur Formulierung des "Gessner-Wassers" geführt hat, kann kaum überschätzt werden -
dem Überbringer H-J Krause sei gedankt!

Aber Achtung:
Die Leitungsgewässer unserer Stadtwerke entsprechen dem nicht!
Bei der Optimierung werden wir darauf zurückkommen...

Wie oben schon gesagt, definieren die sieben Hauptionen
Auf jeder Mineralwasser-Flasche finden wir deshalb den Gehalt dieser sieben Ionen; hier gibt es eine gute Übersicht. Die Leitungswasser kann man auf den Websites des Stadtwerke finden -
wir werden sie später brauchen.
Ca++, Mg++, Na+, K+, SO4--, Cl-, HCO3-
das Süßwasser.
das Süßwasser.
Auf jeder Mineralwasser-Flasche finden wir deshalb den Gehalt dieser sieben Ionen; hier gibt es eine gute Übersicht. Die Leitungswasser kann man auf den Websites des Stadtwerke finden -
wir werden sie später brauchen.


Neumünster, 09.12.2022 *
Egbert W Gerlich *
egbert@ew-gerlich.de