|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
b. Haupt-Ionen II
Wasserhärte
Leitfähigkeit
Wasserhärte
Definitionsgemäß haben beide überhaupt nichts miteinander zu tun, es gibt keinerlei Abhängigkeit, keine Verknüpfung.
KH kein Teil von GH
GH ist kein Überbegriff
KH kann größer sein als GH
GH ist kein Maß für die Salinität
Über die Gesamt-Salinität, den Gesamt-Gehalt an Haupt-Ionen, sind beide Härtegrade nicht aussagefähig, da sie jeweils nur einen begrenzten Teil beschreiben - auch die Gesamthärte ist dafür kein Maß! Der häufig benutzte Begriff
"Nicht-Karbonat-Härte NKH"
Für das Gessner-Wasser gilt
Wird das Wasser mit demineralisiertem Wasser verdünnt, reduzieren sich mit den Ionen-Konzentrationen die Härtegrade GH und KH, aber die Struktur und damit die Härte-Relation RH bleiben erhalten.
Für das Gessner-Wasser können wir uns ein Bild machen von den


Ganz einfach:
Calcium Ca, Magnesium Mg, Natrium Na, Kalium K,
Chlorid Cl, Sulfat SO4, Hydrogencarbonat HCO3.
Wir benennen Ca+Mg = GH und HCO3 = KH; somit
GH + (Na+K) = KH + (Cl+SO4)
In üblichen Wasser ist
KH = 0,9 GH
______________________________________________________
__________________________________________________________
Der natürliche Zusammenhang KH = 0,9 GH kann als Verhältnis KH/GH = 0,9 geschrieben werden,
und das ist die Härterelation RH = KH/GH.
Die Relation die ist das Kennzeichen für die Art des Mineralgehalts,
der Leitwert ist das Kennzeichen für dessen Höhe.

HCO3- + p+ = HCO3- + H+ = H2CO3
H2CO3 = H2O + CO2
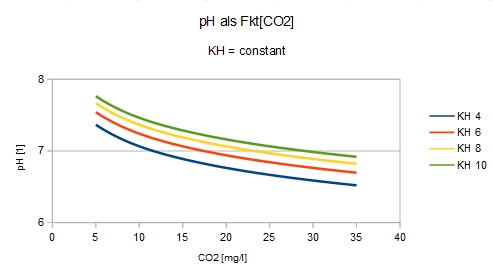
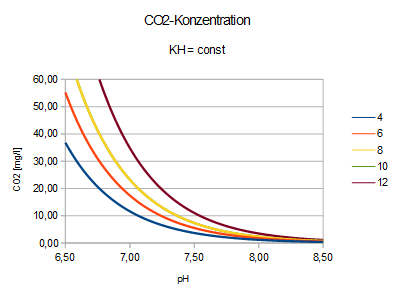
Säuregrad pH - Kohlendioxid CO2 - Karbonat-Härte KH
pH = 7,91 – lg(2,8 * CO2 / KH)

Wasser ist nicht gleich Wasser, Leitungswasser kein naturnahes Wasser. Hier einige Beispiele:

Leitfähigkeit

[Schreibweise: yS = µS]
Bekanntlich zeigen an
die Gesamthärte GH den Gehalt an Erdalkali,
die Karbonathärte KH den Gehalt an (Hydrogen-)Karbonaten;
Das reine GESSNER-Wasser
hat einen Leitwert pro Gesamthärte von ungefähr
50 [(µS/(cm)/°GH]
Ein zu hoher Leitwert fordert zum Wasserwechsel auf,
ein steiler Anstieg zur Problemanalyse.

der in Abhängigkeit vom Verschmutzungsgrad irgendwo zwischen 0,5 und 0,9 liegensoll. Der Wert dieser Größe ist - zumal linear mit dem Leitwert EC verknüpft - nur schwer ersichtlich.


Der Leitwert beschreibt die Konzentration aller gelösten Stoffe,
die Härte-Relation die Struktur der Haupt-Mineralien,
der pH-Wert die Konzentration freier Protonen.

1. ANORGANISCHE ASPEKTE
b. Haupt-Ionen II
Wasserhärte
Leitfähigkeit
Wasserhärte
Die
"Härte" des Wassers ist keineswegs eine Stoffeigenschaft wie die von
Feststoffen bekannte Materialhärte, sie ist auch keine physikalische
Eigenschaft der Flüssigkeit, sondern sie ist ein Maß für die
Konzentration bestimmter, ausgewählter Ionen. Es ist nicht von
Bedeutung, wie es zu den Definitionen der Härte-Arten
"Gesamthärte, Karbonathärte" und der missverständlichen
Namensgebung kam.
Die Gesamthärte GH Ca++ und Mg++ in "Grad deutscher Härte [°dH]", speziell "Grad Gesamthärte [°GH] Es ergeben je 7,174 [mg/l] Ca++ = 1 [ºGH] bzw 4,351 [mg/l] Mg++ = 1 [ºGH] | Die Karbonathärte KH HCO3- in "Grad deutscher Härte [°dH]", speziell "Grad Gesamthärte [°GH] Es ergeben je 21,7827 [mg/l] HCO3- = 1 [ºKH] das entspricht 29,990 [mg/l] NaHCO3 bzw 35,741 [mg/l] KHCO3 |
Definitionsgemäß haben beide überhaupt nichts miteinander zu tun, es gibt keinerlei Abhängigkeit, keine Verknüpfung.
KH kein Teil von GH
GH ist kein Überbegriff
KH kann größer sein als GH
GH ist kein Maß für die Salinität
Härtegrade und Konzentration der betreffenden Ionen sind linear verknüpft:
Mehrfache Konzentration < > mehrfache Härte




Über die Gesamt-Salinität, den Gesamt-Gehalt an Haupt-Ionen, sind beide Härtegrade nicht aussagefähig, da sie jeweils nur einen begrenzten Teil beschreiben - auch die Gesamthärte ist dafür kein Maß! Der häufig benutzte Begriff
für eine rechnerische Differenz (GH [°GH] minus KH [°KH])
sagt nichts
für uns Interessantes aus, zumal es dann eine "negative Härte" geben
müsste,
was immer das sein mag. Man kann Erdalkali und Karbonate ebensowenig von
einander abziehen wie die berühmten Äpfel von Birnen. Die NKH beschreibt allerdings, was - durch welche
Maßnahmen auch immer - nicht als wasserunlösliches Caciumcarbonat
Ca2CO3 ausgeschieden werden kann, weil dann bereits alles CO3-- bzw
(bei negativer NKH) Ca++ ausgefallen ist. NKH zeigt also für diesen Fall die
Überbleibsel von Ca++ bzw HCO3-.
Zweckmäßiger zu betrachten ist das Verhältnis der Karbonate zu den Erdalkali, das genannt sei
Zweckmäßiger zu betrachten ist das Verhältnis der Karbonate zu den Erdalkali, das genannt sei
Härte-Relation RH [%] = KH [°KH] : GH [°GH]
Für das Gessner-Wasser gilt
RH = 92 [%]
KH = 10,5 [ºKH]
GH = 11,4 [ºGH]
Wird das Wasser mit demineralisiertem Wasser verdünnt, reduzieren sich mit den Ionen-Konzentrationen die Härtegrade GH und KH, aber die Struktur und damit die Härte-Relation RH bleiben erhalten.
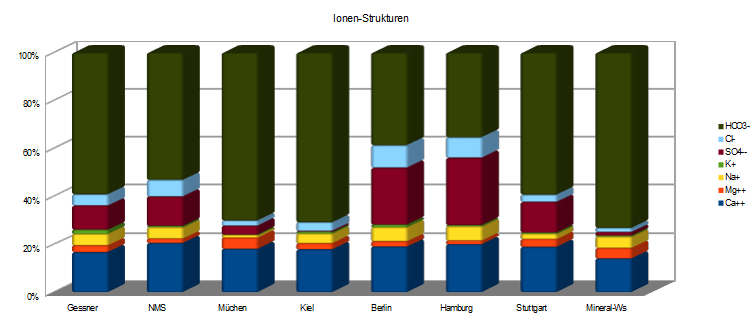
Für das Gessner-Wasser können wir uns ein Bild machen von den
Ladungs-Relationen [mg/l]
Kationen: Ca++, Mg++, Na+, K+ Anionen: HCO3-, SO4--, Cl-
Anionen: HCO3-, SO4--, Cl-
Härterelation = Hinweis auf Mineral-Konzentrationen
RH>90 = Natrium-Kalium-Überschuss
RH<90 = Schwefel-Clorid-Überschuss
Über
den Gesamtgehalt an Ionen sagt auch die Härte-Relation nichts aus -
einen Hinweis gibt die noch zu besprechende Leitfähigkeit...Im
folgenden Diagramm stehen unten GH-Kationen und KH-Anionen,
darüber die anderen Hauptionen, über deren Konzentration quantitativ nichts
ausgesagt werden kann - außer qualitativ zu Überschüssen (gelb, grün), da die Ladungssumme aller Kationen der der Anionen entspricht (100%).Kationen: Ca++, Mg++, Na+, K+
 Anionen: HCO3-, SO4--, Cl-
Anionen: HCO3-, SO4--, Cl- Härterelation = Hinweis auf Mineral-Konzentrationen
RH>90 = Natrium-Kalium-Überschuss
RH<90 = Schwefel-Clorid-Überschuss


Ganz einfach:
Geprägt wird Wasser durch die wichtigsten Mineralien
Chlorid Cl, Sulfat SO4, Hydrogencarbonat HCO3.
Im Gleichgewicht stehen sich gegenüber (Ca + Mg) + (Na + K) = (Cl + SO4) + HCO3
Jedes Trinkwasser wird so gekennzeichnet...
GH + (Na+K) = KH + (Cl+SO4)
In üblichen Wasser ist
KH = 0,9 GH
______________________________________________________
Beispiel:
Wenn GH=8, dann sollte KH bei 7,2 liegen.
Wenn nicht, wenn
Wenn GH=8, dann sollte KH bei 7,2 liegen.
Wenn nicht, wenn
zB KH=6, also weniger KH, d.h. HCO3-Mangel = (Cl+SO4)-Überschuss
zB KH=10, also weniger GH, d.h. (Ca+Mg)-Mangel = (Na+K)-Überschuss
Der natürliche Zusammenhang KH = 0,9 GH kann als Verhältnis KH/GH = 0,9 geschrieben werden,
und das ist die Härterelation RH = KH/GH.
Die Relation die ist das Kennzeichen für die Art des Mineralgehalts,
der Leitwert ist das Kennzeichen für dessen Höhe.

Für den Säuregrad hat die Karbonat-Härte besondere Bedeutung:
Wenn Stoffe, die Protonen abgeben (zB Säuren) eingeleitet werden und dadurch ein bedeutender Protonenüberschuss entsteht,
verbinden sich Karbonat-Ionen mit den Protonen, wodurch
Wenn Stoffe, die Protonen abgeben (zB Säuren) eingeleitet werden und dadurch ein bedeutender Protonenüberschuss entsteht,
verbinden sich Karbonat-Ionen mit den Protonen, wodurch
im Wasser gelöstes Kohlendioxid verbleibt bzw ausperlt,
der Protonen-Überschuss reduziert,
ein "pH-Absturz" aufgefangen wird.
der Protonen-Überschuss reduziert,
ein "pH-Absturz" aufgefangen wird.
HCO3- + p+ = HCO3- + H+ = H2CO3
H2CO3 = H2O + CO2
Deshalb wird die Karbonathärte in der
Hydrologie als
.

In einem festen Verhältnis stehen die Karbonate zu Säuregrad und Kohlendioxid-Gehalt:
„Säurebindungsvermögen SBV“
bezeichnet, wodurch
gleichzeitig das landläufige Missverständnis in Bezug auf die
Gesamthärte vermieden wird. Das Anion der Säure verbleibt natürlich als Verunreinigung
im Wasser, aber ein unkontrollierter „Säureschock“ durch dissoziierte Protonen bleibt weitestgehend vermieden:.
HCl = Cl- + p+
HCl + HCO3- = H2O + CO2 + Cl-
H2SO4 = SO4-- + 2*p+
H2SO4 + 2* HCO3- = 2* H2O + 2* CO2 + SO4--
HCl + HCO3- = H2O + CO2 + Cl-
H2SO4 = SO4-- + 2*p+
H2SO4 + 2* HCO3- = 2* H2O + 2* CO2 + SO4--

In einem festen Verhältnis stehen die Karbonate zu Säuregrad und Kohlendioxid-Gehalt:
Säuregrad pH - Kohlendioxid CO2 - Karbonat-Härte KH
pH = 7,91 – lg(2,8 * CO2 / KH)
Bei
gleichbleibender KH, d.h. bei gleichbleibender HCO3-Konzentration, wird
der pH-Wert vom CO2 -Gehalt bestimmt; gesenkt wird er durch CO2-Zugabe,
erhöht durch CO2-Verbrauch. Alles Andere stört auf gefährliche Weise
die Ionen-Struktur.



Wasser ist nicht gleich Wasser, Leitungswasser kein naturnahes Wasser. Hier einige Beispiele:

Sieht
das Stuttgarter Stadtwasser noch recht annehmbar aus, ist das Wasser in
Hamburg und Berlin sehr schwefelhaltig, und München zeigt fast nur
Härte. Inwieweit das repariert werden kann, muss für jeden Einzelfall
untersucht werden - das Werkzeug dazu wird im Optimierungsteil
vorgestellt.

Leitfähigkeit
Das Durcheinder-Gewusele vieler geladener
Teilchen, was anschaulich das Wasser beschreibt, bedingt, dass übliches Wasser (von reinem H2O abgesehen)
einem eingeleiteten elektrischen Strom nur wenig Widerstand
entgegensetzt, sondern ihn vielmehr gefährlich gut weiterleitet. Diese
Leitfähigkeit (= Kehrwert des elektrischen Widerstandes) ist gegeben
durch das Leitungsvermögen aller Ionen, die so, wie sie eine
spezifische Masse besitzen, ihre ganz spezifische Leitfähigkeit haben
(die Einheit ist "MilliSiemens pro Zentimeter": mS/cm). So kann man,
wenn die Ionen-Massen bekannt sind, die Leitfähigkeit errechnen. Von Bedeutung sind diese Daten:

[Schreibweise: yS = µS]
Bekanntlich zeigen an
die Gesamthärte GH den Gehalt an Erdalkali,
die Karbonathärte KH den Gehalt an (Hydrogen-)Karbonaten;
alles
Andere bleibt unberücksicht. Der Leitwert EC (so pflegt in der Aquaristik
das Ausmaß der Leitfähigkeit nicht ganz korrekt bezeichnet zu werden),
der Leitwert EC zeigt die Gesamt-Mineralisierung
des Wassers an, allerdings ohne Erkennbarkeit
der verschiedenen Stoffe. Hartes Gessner-Wasser hat einen höheren Leitwert,
weiches einen niedrigeren; Neben- und Spuren-Ionen erhöhen den Leitwert,
ebenso organische Humin-Stoffe. Dünger- und Futterzugaben und das
Freiwerden von Mineralien durch abgestorbene Lebewesen erhöhen den
Leitwert - und sie verändern ihn stoff-spezifisch: Dieselbe Masse
Ammonium verändert anders als dieselbe Menge Karbonat.
Natürlich wirkt sich auch die Protonen-Konzentration des sauren Wassers auf die Leitfähigkeit aus, spielt aber nur bei sehr niedrigen pH-Werten von pH < 4 eine Rolle.
Natürlich wirkt sich auch die Protonen-Konzentration des sauren Wassers auf die Leitfähigkeit aus, spielt aber nur bei sehr niedrigen pH-Werten von pH < 4 eine Rolle.
Das reine GESSNER-Wasser
hat einen Leitwert pro Gesamthärte von ungefähr
50 [(µS/(cm)/°GH]

Ist
der Messwert niedriger, fehlen Haupt-Ionen, ist er höher, sind weitere
Ionen durch Dünger und andere Verschmutzungen, wie oben genannt,
vorhanden. Auch Dünger ist eine "Verschmutzung" des Wassers! Die
Messverfahren werden bei den Optimierungen besprochen, hier nur so viel:
Ein zu hoher Leitwert fordert zum Wasserwechsel auf,
ein steiler Anstieg zur Problemanalyse.

Der
Glaube, man könne über den Leitwert Wasserhärte oder gar die Masse der
gelösten Stoffe messen, ist ein Trugschluss. Man kann den Widerstand
des betreffenden Wassers messen, elektrischen (Ionen-)Strom zu leiten,
und ihn in die Leitfähigkeit umrechnen, doch die in der Tabelle oben
gezeigten Werte der Stoffkonstanten verdeutlichen, dass aus der Summe
nicht auf einzelne Ionen oder Ionen-Gruppen geschlossen werden kann.
Trotzdem ist es in der Literatur und auch in Leitwert-Messgeräten
üblich, den ermittelten Leitwert umzusetzen in die "Gesamtheit aller gelösten Feststoffe",
Total Dissolved Solids
TDS [ppm = mg/l]
TDS [ppm = mg/l]
mit einem konstanten Faktor k,
TDS [ppm] = k*EC [µS/cm]
der in Abhängigkeit vom Verschmutzungsgrad irgendwo zwischen 0,5 und 0,9 liegensoll. Der Wert dieser Größe ist - zumal linear mit dem Leitwert EC verknüpft - nur schwer ersichtlich.
Beim reinen GESSNER-Wasser
würde dieser Faktor betragen
k = 0,688
TDS [ppm] = 0,7*EC [µS/cm]
Die Beobachtung des Leitwertes ist die Beobachtung der Verschmutzung.
würde dieser Faktor betragen
k = 0,688
TDS [ppm] = 0,7*EC [µS/cm]
Die Beobachtung des Leitwertes ist die Beobachtung der Verschmutzung.

Da
der Leitwert im Gegensatz zur Wasserhärte alle Mineral-Ionen umfasst,
ist er neben dem pH-Wert der wichtigste Kennwert für die
Beschreibung eines Gewässers - ergänzt wird er von der oben definierten
Härte-Relation RH.
Betrachten wir einige gelöste Stoffe:
1.
Reines Wasser H2O
keine Erdalkali, keine Hydrogencarbonate , keine Mineralstoffe, also GH=0 KH=0 LF=0
2. Kochsalz NaCl keine Erdalkali, keine Hydrogencarbonate, aber Mineralstoffe, also GH=0 KH=0 LF>0
3. Backsoda NaHCO3 keine Erdalkali, aber Hydrogencarbonate, damit Mineralstoffe, also GH=0 KH>0 LF>0
4. Gips CaSO4 Ca als Erdalkali, keine Hydrogencarbonate, damit Mineralstoffe, also GH>0 KH=0 LF>0
5. Kalziumbikarbonat Ca(HCO3)2 Ca als Erdalkali, dazu Hydrogencarbonate, damit Mineralstoffe, also GH=0 KH>0 LF>0
2. Kochsalz NaCl keine Erdalkali, keine Hydrogencarbonate, aber Mineralstoffe, also GH=0 KH=0 LF>0
3. Backsoda NaHCO3 keine Erdalkali, aber Hydrogencarbonate, damit Mineralstoffe, also GH=0 KH>0 LF>0
4. Gips CaSO4 Ca als Erdalkali, keine Hydrogencarbonate, damit Mineralstoffe, also GH>0 KH=0 LF>0
5. Kalziumbikarbonat Ca(HCO3)2 Ca als Erdalkali, dazu Hydrogencarbonate, damit Mineralstoffe, also GH=0 KH>0 LF>0

Der Leitwert beschreibt die Konzentration aller gelösten Stoffe,
die Härte-Relation die Struktur der Haupt-Mineralien,
der pH-Wert die Konzentration freier Protonen.

Neumünster, 09.02.2024 *
Egbert W Gerlich *
egbert@ew-gerlich.de