|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
e. Gase I
Stickstoff
Kohlendioxid
Gelöste Gase
für
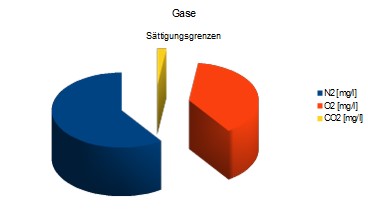
N2: 14,2 [mg/l], CO2: 0,51 [mg/l], O2: 9,1 [mg/l]

Stickstoff N2



Kohlendioxid CO2
pH > KH <
! !
Durch den Entzug des Hydoxid-Ions verschiebt sich die Protonen-Hydoxid-Relation zu den positiven Protonen: Das Wasser säuert an, der pH-Wert sinkt. Gleichzeitig steigt die Karbonat-Härte durch das vermehrte Hydrogenkarbonat HCO3-. Dieser Zusammenhang von pH, KH und CO2 wird beschrieben durch


1. ANORGANISCHE ASPEKTE
e. Gase I
Stickstoff
Kohlendioxid
Gelöste Gase
Nicht
alle Stoffe, die sich im Wasser in ihre Bausteine auflösen,
dissoziieren in elektrisch geladene Ionen, sondern sie schwirren als
elektrisch neutrale, also ungeladene Moleküle durchs Wasser. Im
Wesentlichen sind dies Gase, wie sie auch in der atmosphärischen Luft
vorkommen, nämlich
| Stickstoff N2 | Kohlendioxyd CO2 | Sauerstoff O2 |
 |  |  |
An
der Grenzschicht zur Luft, also der Wasseroberfläche, „diffundieren“
die Gase, die Konzentrationen ausgleichend, wechselnd aus dem Wasser in
die Luft oder aus der Luft ins Wasser - je mehr Bewegung und je höher
die Temperatur, desto schneller. Ins Wasser diffundieren sie so lange,
bis ein Gleichgewichtszustand erreicht ist. Ist die Gaskonzentration im
Wasser aufgrund anderer chemischer oder biochemischer Vorgänge höher,
diffundieren die Moleküle aus dem Wasser in die Luft.
Diese Gleichgewichts-Grenzen sind für
N2: 14,2 [mg/l], CO2: 0,51 [mg/l], O2: 9,1 [mg/l]

Das Wasser kann temporär mehr oder auch weniger dieser Mengen
enthalten, ein Gas-Überschuss entweicht nach und nach in die Atmosphäre - langfristig stellt sich ein Gleichgewicht ein.

Stickstoff N2

Stickstoff N2, der mit knapp 80% den größten Teil unserer Atemluft bildet, ist als doppelatomiges Molekül
N2 recht stabil und reaktionsträge, er spielt als molekulares Gas keine
erwähnenswerte Rolle - anders, wenn er sich mit anderen Stoffen (wie
Sauerstoff) verbunden hat, wie schon gezeigt wurde.
Deshalb wird er hier nur der Vollständigkeit halber erwähnt, obwohl er in nenneswerter Konzentration auch im Wasser vorhanden ist.
Deshalb wird er hier nur der Vollständigkeit halber erwähnt, obwohl er in nenneswerter Konzentration auch im Wasser vorhanden ist.


Kohlendioxid CO2

Es
wurde schon dargelegt, dass gelöstes CO2 teilweise Hydoxid-Ionen HO- an
sich bindet und somit durch Hydroxid-Abbau den Säuregrad erhöht:
CO2 + (HO- + p+) = HCO3- + p+pH > KH <
! !
Durch den Entzug des Hydoxid-Ions verschiebt sich die Protonen-Hydoxid-Relation zu den positiven Protonen: Das Wasser säuert an, der pH-Wert sinkt. Gleichzeitig steigt die Karbonat-Härte durch das vermehrte Hydrogenkarbonat HCO3-. Dieser Zusammenhang von pH, KH und CO2 wird beschrieben durch
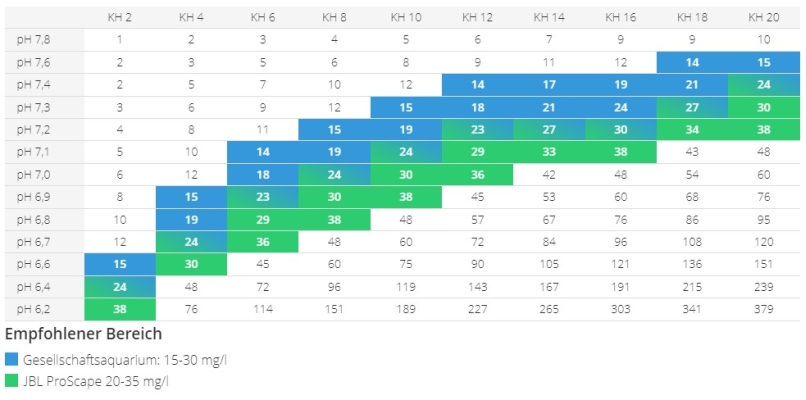
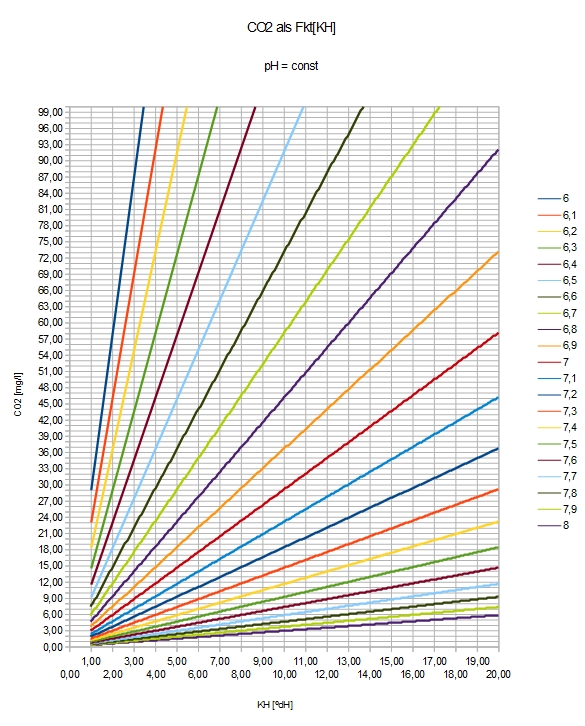
| pH = 7,91 - lg(2,8*CO2/KH) | CO2 = (KH/2,8) * 10^(7,91-pH) | KH = (2,8*CO2) / [10^(7,91-pH)] |
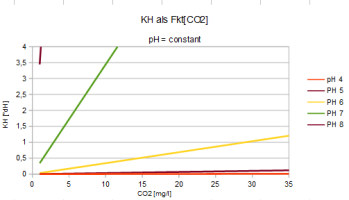 | 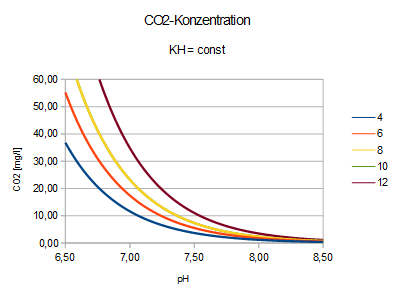 | 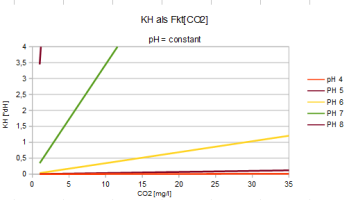 |
Bei gegebener Mineralstruktur wird
- der Säuregrad gesteuert vom CO2-Gehalt: CO2 < 80 [mg/l]
- ein saures Milieu erreicht bei weichem Wasser: KH < 8 [ºdH]
- ein saures Milieu erreicht bei weichem Wasser: KH < 8 [ºdH]

Es wird der pH-Wert
gesenkt durch Zugabe von CO2
erhöht durch Zugabe von HCO3-
erhöht durch Zugabe von HCO3-

Neumünster, 11.12.2022 *
Egbert W Gerlich *
egbert@ew-gerlich.de