|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
e. Gase II
Sauerstoff
Redox, Chelate
Chlor
Sauerstoff

Das Vermögen, Redox-Reaktionen in Gang zu setzen, nennt man „Redox-Potential“, und es wird im Wasser weitestgehend (wenngleich nicht allein) vom O2-Gehalt bestimmt - Genaueres ist hier nicht von Bedeutung. Das Potential ist als elektrische Spannung in Volt [V] messbar.
Je höher die O2-Konzentration,
desto höher die Redox-Spannung,
desto höher das Reaktionsvermögen,
desto höher die Stoffumwandlungen im Wasser.
Der Redox-Wert gibt einen Anhalt für die O2-Konzentration.

Das Reaktionsvermögen wird als "Redox-Vermögen rH" bezeichnet, wobei auch hier der Säuregrad eine, wenngleich eher untergeordnete Rolle spielt.
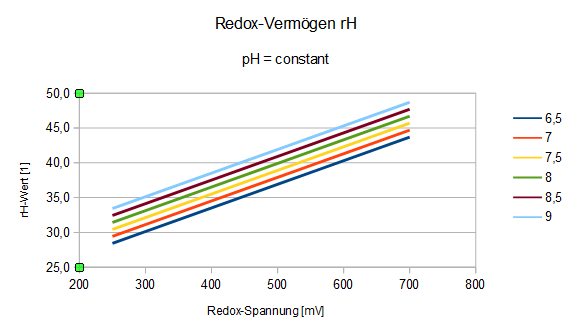
Das Redox-Vermögen zeigt die Fähigkeit, Stoffumwandlungen vorzunehmen.

Gefährdet wird die Versorgung mit Spuren-Ionen durch
- hohe Redox-Werte (O2-Überschuss)
- hohe pH-Werte (HO-_Überschuss)


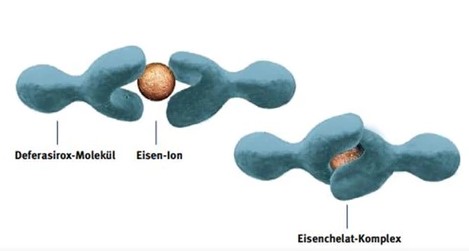
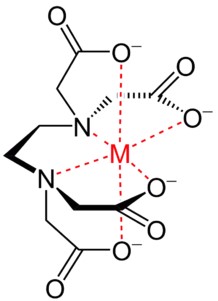
Die folgenden Darstellungen der chemischen Anbindungen verdeutlichen, wie der zu schützende Stoff im Zentrum von den Liganden ummantelt wird:
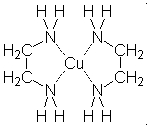
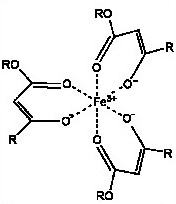
Kupfer-Chelat Eisen-Chelat
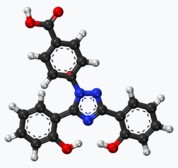
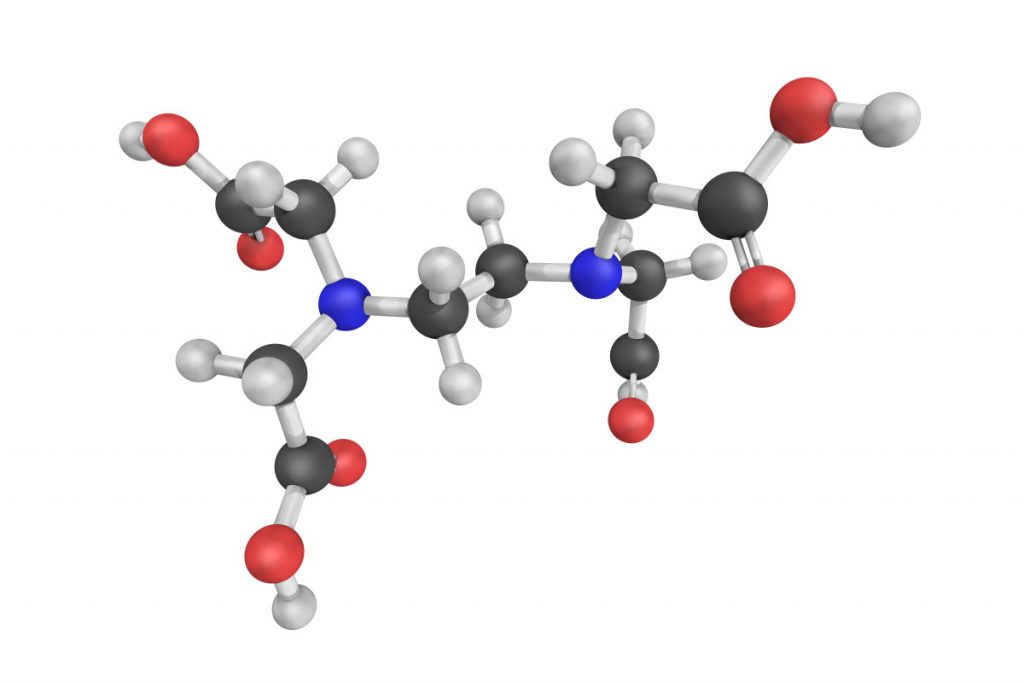
Der im Bild oben genannte Ligand Ein häufig verwendeter Ligand ist
"Deferasirox" im Modell EDTA "Ethylen-diamin-tetra-acetat"

Dass sich die Sauerstoff-Konzentration im Wasser bei stabilen Verhältnissen auf 9,1 [mg/l] einpendelt, weil die O2-Moleküle an der Trennfläche der beiden Fluide "Wasser" und "Luft" zur Korrektur jeweils in das untersättigte Volumen auswandern ("Diffusion"), haben wir oben schon dargelegt.
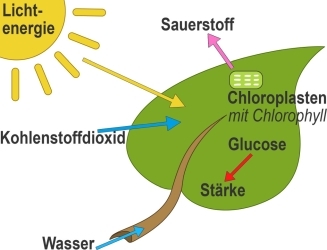
unter Energie-Zufuhr (Licht) Kohlendioxid CO2 und Wasser H2O umgewandelt werden in Sauerstoff O2 und Glucose C6H12O6 ("Traubenzucker"). Die Pflanze nimmt CO2 auf, arbeitet das Kohlehydrat (hier: Zucker) in die Pflanzensubstanz ein und gibt O2 ab
6* H2O + 6* CO2 = C6H12O6 + 6* O2
108[g] H2O & 264[g] CO2 > 192[g] C6H12O6 & 180[g] O2

Pro Gramm Neu-Substanz erzeugt eine Wasserpflanze 450 Milligramm Sauerstoff .

 >>
>>  &
& 
H2O2 H2O O2
Noch reaktionsfreudiger als der zwei-atomige O2-Molekül ist das drei-atomige Ozon O3, das deshalb zur Vernichtung von Mikro-Organismen (Algen, Pilze, Bakterien) eingesetzt wird. In natürlichem Wasser kommt es ebenfalls nicht vor. Zur O2-Anreicherung eingesetzt, treibt es das Redox-Potential in die Höhe:
 >>
>> 
O3 O2

Chlor-Gas

In natürlichem Süßwasser eine unerwünschte Verunreinigung.

1. ANORGANISCHE ASPEKTE
e. Gase II
Sauerstoff
Redox, Chelate
Chlor
Sauerstoff

Sauerstoff
ist ein äußerst reaktionsfreudiges Element, es verbindet sich leicht
mit anderen Stoffen - mit Ionen, Atomen, Molekülen - zu neuen, völlig
anders gearteten Stoffen; man nennt diese „Oxide“.
Er verbindet sich mit
Wasserstoff zu Wasser: 2* H2 + O2 = 2* H2O
Kohlenstoff zu Kohlenmonoxid: 2* C + O2 = 2* CO
zu Kohlendioxid: C + O2 = CO2
Eisen
zu „Rost“:
2* Fe2+ + O2 =
2* FeO und
4* Fe3+ + 3* O2 = 3* Fe2O3
4* Fe3+ + 3* O2 = 3* Fe2O3
Mangan
zu Manganoxid:
Mn++ + O2 = MnO2
Nitrit
zu Nitrat:
2* NO2- + O2 =
2* NO3-
Diese
Vorgänge heißen „Oxidation“; gleichzeitig wird einem anderen Molekül
das Sauerstoff-Atom entzogen, dieser Parallel-Vorgang heißt
„Reduktion“. Beide Reaktionen zusammen bilden die
"Redox“-Reaktion
Das Vermögen, Redox-Reaktionen in Gang zu setzen, nennt man „Redox-Potential“, und es wird im Wasser weitestgehend (wenngleich nicht allein) vom O2-Gehalt bestimmt - Genaueres ist hier nicht von Bedeutung. Das Potential ist als elektrische Spannung in Volt [V] messbar.
Je höher die O2-Konzentration,
desto höher die Redox-Spannung,
desto höher das Reaktionsvermögen,
desto höher die Stoffumwandlungen im Wasser.
Der Redox-Wert gibt einen Anhalt für die O2-Konzentration.

Das Reaktionsvermögen wird als "Redox-Vermögen rH" bezeichnet, wobei auch hier der Säuregrad eine, wenngleich eher untergeordnete Rolle spielt.

Das Redox-Vermögen zeigt die Fähigkeit, Stoffumwandlungen vorzunehmen.

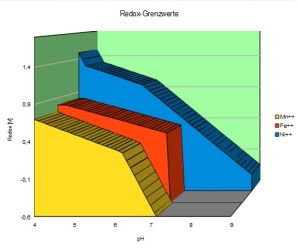
Ganz besonders betroffen sind leider die Spurenelemente, aber gerade auch Metalle.
Vom Eisen wurde schon dargelegt, dass das fürs Leben notwendige Fe++-Ion nur in einem kleinen Bereich des Säure-Redox-Feldes existiert, außerhalb das Eisen aber ausfällt. Ebenso betroffen sind das ebenso wichtige Mn++-Ion und viele andere. Beispiele sind hier
Mangan, Eisen und Nickel.Vom Eisen wurde schon dargelegt, dass das fürs Leben notwendige Fe++-Ion nur in einem kleinen Bereich des Säure-Redox-Feldes existiert, außerhalb das Eisen aber ausfällt. Ebenso betroffen sind das ebenso wichtige Mn++-Ion und viele andere. Beispiele sind hier

Gefährdet wird die Versorgung mit Spuren-Ionen durch
- hohe Redox-Werte (O2-Überschuss)
- hohe pH-Werte (HO-_Überschuss)

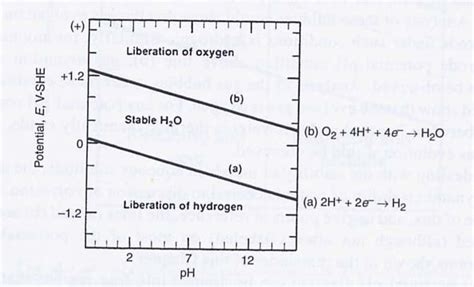
Sogar die Stabilität des Wassers selbst ist abhängig vom pH-Redox-Verhältnis, wie das Pourbaix-Diagramm von Wasser zeigt:

Bei
hohem Redox-Potential mit steigendem pH-Wert, also oberhalb der Linie
(b) werden in Umkehrung der Gleichung (b) beide Gase H2 & O2
molekular abgegeben
H2O > O2 + 2* H2bei
negativem Redox-Potential mit sinkendem pH-Wert, also unterhalb der
Linie (a), wird nach Gleichung (a) Wasserstoff H2 molekular abgegeben
2* H+ + 2* e- = H2 
Viele Stoffe, besonders Ionen, werden in sauerstoffreichem oder
in alkalischem Wasser, also bei hohem Redoxpotential bzw bei
Protonenmangel, sehr schnell oxidiert oder an andere Stoffe gebunden,
so dass sie für die "Abnehmer" verloren gehen. Um diese Instabilität hinauszuzögern und
die ursprünglichen Stoffe zu erhalten, müssen sie besonders durch
"Chelatieren" geschützt werden,
Die Reaktion des Chelatierens bewirkt eine schützende Ummantelung des zu schützenden Ions, indem an die offenen Ankoppelungsstellen (bei Anionen die Elektronen-Lücken) durch spezifisch geeignete "Liganden" besetzt werden, zumeist organische Verbindungen, also "Kohlenwasserstoffe -CH-". Die Wirkungsweise ist hier sehr anschaulich dargestellt:
Wirkung von Liganden beim Chelatierenals "Chelate" bleiben sie verfügbar.
Die Reaktion des Chelatierens bewirkt eine schützende Ummantelung des zu schützenden Ions, indem an die offenen Ankoppelungsstellen (bei Anionen die Elektronen-Lücken) durch spezifisch geeignete "Liganden" besetzt werden, zumeist organische Verbindungen, also "Kohlenwasserstoffe -CH-". Die Wirkungsweise ist hier sehr anschaulich dargestellt:

Die folgenden Darstellungen der chemischen Anbindungen verdeutlichen, wie der zu schützende Stoff im Zentrum von den Liganden ummantelt wird:
Kupfer-Chelat Eisen-Chelat


Eisen-Chelat
ist von besonderer Wichtigkeit, da das für den Stoffwechsel wichtige
Fe++ so lang genug erhalten bleibt und gut von Lebewesen aufgenommen
wird. Somit kann auch verhindert werden, dass Eisen als unlösliches Eisenphosphat ausfällt, was zu Eisen- und gleichzeitig auch Phosphat-Mangel führt:
3* Fe++ + 2* PO4--- = Fe3(PO4)2 Der im Bild oben genannte Ligand Ein häufig verwendeter Ligand ist
"Deferasirox" im Modell EDTA "Ethylen-diamin-tetra-acetat"




Im Wesentlichen gelangt Sauerstoff ins Wasser durch
- Oberflächendiffusion (s.o.)
- bio-chemische Umwandlungen der Pflanzen (u.a. Photosynthese)
- gezielte Zugabe
- bio-chemische Umwandlungen der Pflanzen (u.a. Photosynthese)
- gezielte Zugabe
Dass sich die Sauerstoff-Konzentration im Wasser bei stabilen Verhältnissen auf 9,1 [mg/l] einpendelt, weil die O2-Moleküle an der Trennfläche der beiden Fluide "Wasser" und "Luft" zur Korrektur jeweils in das untersättigte Volumen auswandern ("Diffusion"), haben wir oben schon dargelegt.

Ebenso haben wir auch gesehen, wie durch das Wachstum der Pflanzen, deren Substanz vorwiegend aus NO3-, PO4---, CO2 und H2O gebildet wird, überschüssiges O2 freigesetzt wird - pro Gramm Pflanzensubstanz immerhin fast ein halbes Gramm Sauerstoff-Gas O2.
Der wichtigste bio-chemische Vorgang ist die Photosynthese, bei der - vereinfacht -

unter Energie-Zufuhr (Licht) Kohlendioxid CO2 und Wasser H2O umgewandelt werden in Sauerstoff O2 und Glucose C6H12O6 ("Traubenzucker"). Die Pflanze nimmt CO2 auf, arbeitet das Kohlehydrat (hier: Zucker) in die Pflanzensubstanz ein und gibt O2 ab
108[g] H2O & 264[g] CO2 > 192[g] C6H12O6 & 180[g] O2
Zusätzlich werden Wasser und Proteine in die Substanz eingebaut, so dass nach Redcliff dieses Verhältnis entsteht:

Pro Gramm Neu-Substanz erzeugt eine Wasserpflanze 450 Milligramm Sauerstoff .

Mit Wasserstoff kann sich Sauerstoff nicht nur zu Wasser H2O verbinden,
sondern auch zu hoch aggressiven Wasserstoff-Peroxid H2O2, das in natürlichem Wasser
nicht vorkommt.
Im Wasser gelöst, erhöht es die Konzentration des Sauerstoffs, indem es diesen freisetzt. Vorsichtig eingesetzt, hat es sich anscheinend bewährt, um den Redox-Wert zu steuern.
2* H2O2 = 2* (HO- + H+) + O2 Im Wasser gelöst, erhöht es die Konzentration des Sauerstoffs, indem es diesen freisetzt. Vorsichtig eingesetzt, hat es sich anscheinend bewährt, um den Redox-Wert zu steuern.
 >>
>>  &
& 
H2O2 H2O O2
Noch reaktionsfreudiger als der zwei-atomige O2-Molekül ist das drei-atomige Ozon O3, das deshalb zur Vernichtung von Mikro-Organismen (Algen, Pilze, Bakterien) eingesetzt wird. In natürlichem Wasser kommt es ebenfalls nicht vor. Zur O2-Anreicherung eingesetzt, treibt es das Redox-Potential in die Höhe:
a) 2* O3 = 2* O2 + 2* O
b) 2* O3 = 2* O2 + O2 = 3* O2
b) 2* O3 = 2* O2 + O2 = 3* O2
Für
kurze Zeit wird gem obiger Reaktions-Gleichung "a" atomarer Sauerstoff
O abgespalten, der hoch-aggressiv neue Verbindungen eingehen kann, bis
er sich wieder zu weiteren O2-Molekülen zusammenbindet ("b"). Deshalb
ist Ozon O3 ein noch stärkeres Desinfektionsmittel. Darauf wird noch einzugehen sein.
 >>
>> 
O3 O2

Chlor-Gas

Auch die
zwei-atomigen Chlor-Molekühle Cl2 - elektrisch neutral, nicht zu verwechseln mit dem Haupt-Kation Chlorid
Cl- ! - kommen in natürlichem Wasser nicht vor.
Sehr aggressiv, wirkt es für nahezu alle Lebewesen als starkes Gift,
weshalb es künstlich zur Desinfektion eingesetzt wird.
In Anwesenheit von Aktiv-Kohle, fein-porösem Kohlenstoff, kommt es im Wasser zur Freisetzung von Protonen
2* Cl2 + 2* H+ + 2* HO- = 4* HCl + O2 = 4* H+ + 4* Cl- + O2 In Anwesenheit von Aktiv-Kohle, fein-porösem Kohlenstoff, kommt es im Wasser zur Freisetzung von Protonen
Die folgende pH-Absenkung durch den Protonenüberschuss muss durch die Hydrogenkarbonate aufgefangen werden:
4* H+ + 4* HCO3- = 4* H+ + 4* HO- + 4* CO2 In natürlichem Süßwasser eine unerwünschte Verunreinigung.

Neumünster, 10.12.2022 *
Egbert W Gerlich *
egbert@ew-gerlich.de