|
Zur Hydrologie des Süßwasser-Aquariums |

|
Aquaristik:
Die Grundlagen verstehen
1. ANORGANISCHE ASPEKTE
c. Neben-Ionen
Stickstoffe
Redfield-Relationen

Stickstoffe

H4N2CO NO3- NH4+
[die gelbe Lücke zeigt das hier fehlende Elektron]
weiterhin auch die daraus abgebauten
Nitrit Ammoniak


NO2- NH3
So, wie der Kohlenstoff die Kohlehydrate und Fette regiert, bestimmt Stickstoff die Proteine, alle drei Nährstoffbereiche bilden mit Wasser nahezu vollständig die Körpersubstanz der hier interessierenden Flora und Fauna - die Konzentration verwertbarer Stickstoffverbindungen ist also ebenso bedeutungsvoll wie das Vorhandensein von Kohlenstoff. Nitrit NO2- und Ammoniak NH3 sind nicht nur nicht verwertbar, sondern schädigend, also - falls vorhanden - vollständig zu eliminieren.
Als Stickstoff-Lieferanten kommen im wesentlich in Frage - wenn wir von der direkten Einvernahme von Tier-/Pflanzensubstanz absehen - Moleküle/Ionen von
Urea - Nitrat - Ammonium
als N-Lieferanten
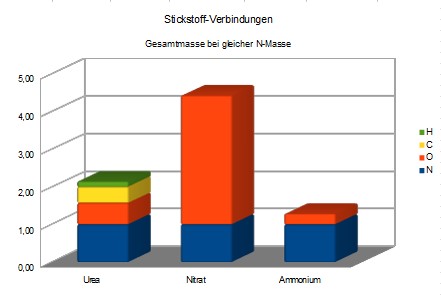
N2H4CO NO3- NH4+


Redfield-Relationen
1x PO4--- 16x NO3- 106x CO2
Durch Multiplikation mit den spezifischen Molekül-Massen ergeben sich folgende

1x P 16x N 106x C 264x H 110x O
sind aufgebaut aus
1x PO4, 16x NO3, 106x CO2, 132x H2O
wobei (4+48+212+22)x O = 143x O2 ins Wasser zurückgeführt werden
Ich nenne sie die
"REDFIELD-Masse-Relationen"
[kg / g / mg]
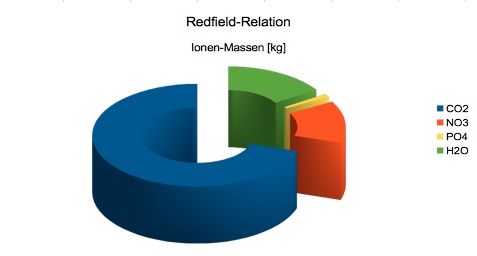
1xPO4 : 16xNO3 : 106xCO2 : 132xH2O {abzgl 143x O2} = 95 : 992 : 4.665 : 2378 {abzgl 4576 .....}
PO4 : NO3 : CO2 : H2O = 1 : 10,5 : 49,1 : 23,3 {abzgl 48,2 }

Es kann ein Pflanzenwachstum erzielt werden bei
Sauerstoff-Rückführung von ~ 50 [mg/l]
100 [mg/l] Pflanzenwachstum erfordern

pH = Fkt[CO2]
NO3 < 1/5 CO2

Optimale Nebenionen-Konzentration ist abhängig vom Kohlendioxid-Gehalt!


1. ANORGANISCHE ASPEKTE
c. Neben-Ionen
Stickstoffe
Redfield-Relationen
In
diese Gruppe gehören Stoffe, die in natürlichem Wasser in
nennenswerten, wechselhaften Mengen vorkommen, ohne zu den das
Süßwasser definierenden Haupt-Ionen zu gehören - streng genommen sind
es Verunreinigungen des reinen Wassers. Ihre Bedeutung liegt vor allem
darin, dass Wasserpflanzen aus ihnen ihre Biomasse bilden, wodurch sie
unerlässlich sind in Pflanzengewässern. Es sind dies Verbindungen von
Stickstoff N, Phosphor P und Kohlenstoff C
Stickstoffe
Stickstoff
als prägendes Element der Proteine ist von größter Bedeutung für nahezu
alle Lebewesen, machen doch Proteine etwa die Hälfte der
Zell-Trockenmasse aus. Wegen des Stickstoff-Gehalts können Proteine
("Eiweiß") auch nicht durch Kohlehydrate oder Fette ersetzt werden, die ja kein Stickstoff enthalten. Hier
von besonderem Interesse sind Stickstoffverbindungen, die für den
Stoffwechsel von Flora und Fauna natürlichen Wassers notwendig sind.
Als Verwesung- und/oder Ausscheidungsprodukte, als Überreste tierischer oder pflanzlicher Proteine ("Eiweiße"), schwirren durch natürliches Wasser die Stickstoff-Verbindungen
Urea ("Harnstoff")
Nitrat
Ammonium
Als Verwesung- und/oder Ausscheidungsprodukte, als Überreste tierischer oder pflanzlicher Proteine ("Eiweiße"), schwirren durch natürliches Wasser die Stickstoff-Verbindungen



H4N2CO NO3- NH4+
[die gelbe Lücke zeigt das hier fehlende Elektron]
weiterhin auch die daraus abgebauten
Nitrit Ammoniak


NO2- NH3
Modelle https://en.wikipedia.org/wiki/Ammonia ff
So, wie der Kohlenstoff die Kohlehydrate und Fette regiert, bestimmt Stickstoff die Proteine, alle drei Nährstoffbereiche bilden mit Wasser nahezu vollständig die Körpersubstanz der hier interessierenden Flora und Fauna - die Konzentration verwertbarer Stickstoffverbindungen ist also ebenso bedeutungsvoll wie das Vorhandensein von Kohlenstoff. Nitrit NO2- und Ammoniak NH3 sind nicht nur nicht verwertbar, sondern schädigend, also - falls vorhanden - vollständig zu eliminieren.
Als Stickstoff-Lieferanten kommen im wesentlich in Frage - wenn wir von der direkten Einvernahme von Tier-/Pflanzensubstanz absehen - Moleküle/Ionen von
Urea - Nitrat - Ammonium
als N-Lieferanten

N2H4CO NO3- NH4+
deren
Stickstoff-Anteil hier im Massen-Vergleich dargestellt ist. Der
stärkste N-Lieferant ist Urea, das von Tieren im Urin ausgeschieden
wird, das aber auch den komplexesten Umwandlungsprozess durchläuft.
Die kritische Umwandlung von NH4+ in NH3 in alkalischem Wasser wurde schon besprochen wie auch die Bedeutung des pH-Wertes für die Bildung von Salpetriger Säure (Basisionen II)
Die kritische Umwandlung von NH4+ in NH3 in alkalischem Wasser wurde schon besprochen wie auch die Bedeutung des pH-Wertes für die Bildung von Salpetriger Säure (Basisionen II)

Die Umwandlung der Stickstoff-Verbindungen ist ein bio-chemischer, um nicht zu sagen "biologischer" Prozess, weshalb er bei den biologischen Aspekten noch zu beleuchten ist. Chemisch geschieht Folgendes:
Bei Vorhandensein jeweils bestimmter Mikro-Organismen und bei jeweils bestimmter Sauerstoff-Konzentration ("Redox-Potential")
(NH3 + p+) + 2*O2 + e- = NO2- + 2*H2OBei Vorhandensein jeweils bestimmter Mikro-Organismen und bei jeweils bestimmter Sauerstoff-Konzentration ("Redox-Potential")
wird Urea N2H4CO zersetzt zu Ammonium NH4+ und Ammoniak NH3
N2H4CO + H2O = NH4+ + NH3 + HCO3
N2H4CO + H2O + p+ = 2*NH4+ + HCO3-
N2H4CO + H2O + p+ = 2*NH4+ + HCO3-
werden Ammonium NH4+ und Ammoniak NH3 beim Stoffwechsel oxidiert zu Nitrit NO2-
wird vorhandes Nitrit NO2- beim Stoffwechsel oxidiert zu Nitrat NO3-
2*NO2- + O2 = 2*NO3-Dieses
NO3-, aber ersatzweise auch NH4+, wird von Pflanzen schnellstmöglich in neue Bio-Masse eingebaut - das Ganze wird besungen als
"Stickstoff-Kreislauf"
wobei
betont werden muss, dass diese Umwandlungen nur möglich sind, soweit
die für jede Stufe
notwendigen Mikro-Organismen
hinlänglich zur
Verfügung stehen. In saurem Wasser entsteht praktisch kein Ammoniak und deshalb kein Nitrit, aber
bei Sauerstoff-Mangel, also bei niedriger Redox-Spannung, und
durch Photolyse bei UV-Bestrahlung kann sich dieser hilfreiche Prozess umkehren, und aus Nitrat wird gefährliches Nitrit
bei Sauerstoff-Mangel, also bei niedriger Redox-Spannung, und
durch Photolyse bei UV-Bestrahlung kann sich dieser hilfreiche Prozess umkehren, und aus Nitrat wird gefährliches Nitrit
2* NO3- = 2* NO2- + O2

Redfield-Relationen
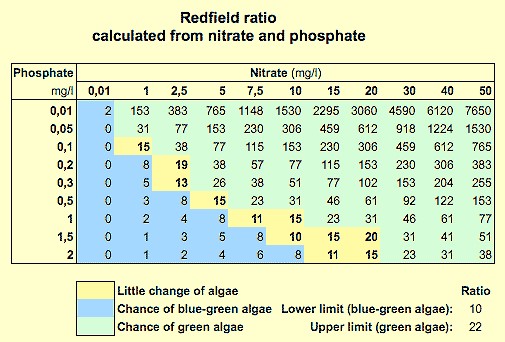
Bei der Untersuchung marinen Phytoplanktons erkannte Alfred C. Redfield einen Zusammenhang des atomaren Gehalts von
Kohlenstoff C : Stickstoff N : Phosphor Pder nach ihm als "Redfield-Verhältnis"
("Redfield Ratio") bezeichnet wurde. Unstrittig für die Meeresbiologie,
ist diese Theorie hilfreich auch für die
Süßwasser-Flora, wenngleich nicht ausreichend untersucht. Analoges gilt für die Buddendorf'sche Algentheorie, wonach eine Algenblüte von unnatürlicher N:P-Relation geprägt ist. Erfahrungswerte deuten auf einen Zusammenhang hin.


Die betreffenden Elemente sind im Wasser wesentlich enthalten in den Kationen von
Phosphat, Nitrat und Kohlendioxid:


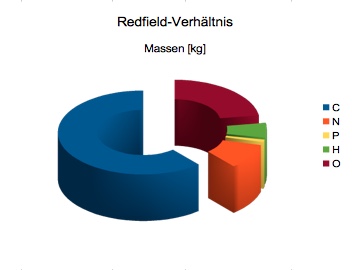
Nach Redfield kommen im Phytoplankton auf
1x P-Atom
16x N-Atome, 106x C-Atome, 264x H-Atome, 110x O-Atome
als Masse ausgedrückt
1.528[g] + 2.025[g] = 3.553[g]
Solange
das Wasser in genügenderMenge zur Verfügung steht - wie im Aquarium -,
kann es zunächst unberücksichtigt bleiben, deshalb16x N-Atome, 106x C-Atome, 264x H-Atome, 110x O-Atome
als Masse ausgedrückt
1.528[g] + 2.025[g] = 3.553[g]

1x P-Atom 16x N-Atome 106x C-Atome
P : N : C = 1 : 16 : 106
P : N : C = 1 : 16 : 106
Die betreffenden Elemente sind im Wasser wesentlich enthalten in den Kationen von
1x PO4--- 16x NO3- 106x CO2
Durch Multiplikation mit den spezifischen Molekül-Massen ergeben sich folgende
Masse-Relationen
[kg / g / mg]
1xPO4 : 16xNO3 : 106xCO2 = 95 : 992 : 4.665
PO4 : NO3 : CO2 = 1 : 10,5 : 49,1
NO3 : PO4 = 10,5 ~ 10
CO2 : PO4 = 49,1 ~ 50
[kg / g / mg]
1xPO4 : 16xNO3 : 106xCO2 = 95 : 992 : 4.665
PO4 : NO3 : CO2 = 1 : 10,5 : 49,1
NO3 : PO4 = 10,5 ~ 10
CO2 : PO4 = 49,1 ~ 50
Auf
dem Weg zum "pflanzenfreundlichen Wasser" sind dies Meilensteine:
NO3 : PO4 = 10 : 1  CO2 : NO3 = 5 : 1
CO2 : NO3 = 5 : 1
 CO2 : NO3 = 5 : 1
CO2 : NO3 = 5 : 1
Nehmen wir jetzt den obigen Wassergehalt hinzu:
1x P 16x N 106x C 264x H 110x O
sind aufgebaut aus
1x PO4, 16x NO3, 106x CO2, 132x H2O
wobei (4+48+212+22)x O = 143x O2 ins Wasser zurückgeführt werden
Ich nenne sie die
"REDFIELD-Masse-Relationen"
[kg / g / mg]
1xPO4 : 16xNO3 : 106xCO2 : 132xH2O {abzgl 143x O2} = 95 : 992 : 4.665 : 2378 {abzgl 4576 .....}
PO4 : NO3 : CO2 : H2O = 1 : 10,5 : 49,1 : 23,3 {abzgl 48,2 }
NO3 : PO4 = 10,5 ~ 10
CO2 : PO4 = 49,1 ~ 50
CO2 : -O2 = 1,02 ~ 1
CO2 : PO4 = 49,1 ~ 50
CO2 : -O2 = 1,02 ~ 1


Es kann ein Pflanzenwachstum erzielt werden bei
NO3- ~ 10 [mg/l]
PO4--- ~ 1 [mg/l]
CO2 ~ 50 [mg/l]
H2O ~ 25 [mg/l]
von ~ 35 [mg/l] bei einer PO4--- ~ 1 [mg/l]
CO2 ~ 50 [mg/l]
H2O ~ 25 [mg/l]
Sauerstoff-Rückführung von ~ 50 [mg/l]
100 [mg/l] Pflanzenwachstum erfordern
NO3- ~ 25 [mg/l]
PO4--- ~ 2,5 [mg/l]
CO2 ~125 [mg/l]
H2O ~ 65 [mg/l]
der überzählige Sauerstoff von ~120 [mg/l] wird ins Wasser zurückgeführt.PO4--- ~ 2,5 [mg/l]
CO2 ~125 [mg/l]
H2O ~ 65 [mg/l]
Wasserpflanzen geben fast ebenso viel Sauerstoff ab, wie sie Kohlendioxid verbrauchen.

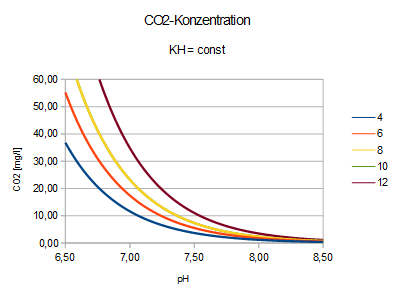
Erinnern wir uns, wie bei bekannter Karbonathärte KH
aus dem pH-Wert die CO2-KonzentrationpH = Fkt[CO2]

abgeleitet
werden kann, und diese bestimmt, REDFIELD folgend, die optimale
Konzentration der Neben-Ionen für Pflanzengewässer, braucht doch und
sollte deshalb die Nitrat-Konzentration ein Fünftel der
Kohlendioxid-Konzentration nicht zu übersteigen:
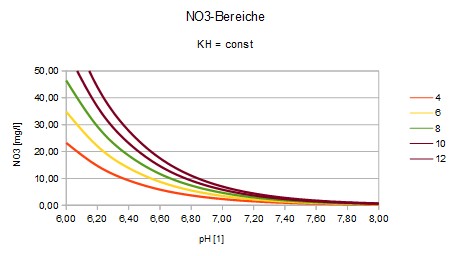
NO3 < 1/5 CO2


Optimale Nebenionen-Konzentration ist abhängig vom Kohlendioxid-Gehalt!
NO3 = 1/5 CO2
PO4 = 1/50 CO2
CO2 = Fkt[pH]
Der Kohlendioxid-Gehalt ergibt sich aus dem pH-WertPO4 = 1/50 CO2
CO2 = Fkt[pH]
Das Diagramm zeigt, dass es keine allgemeine Steuerungs-Empfehlung
geben kann. Auch ist ersichtlich, dass eine höhere Rate des
Pflanzenwachstums tendenziell bei härterem Wasser erreichbar ist,
weil dieses eine höhere CO2-Konzentration ermöglicht (wodurch das
Wasser ansäuert).
weiches Wasser = geringes Wachstum
alkalisches Wasser = geringes Wachstum
alkalisches Wasser = geringes Wachstum

Somit kann das
maximal erzielbare Pflanzenwachstum in Abhängigkeit von Säuregrad und Karbonathärte bestimmt werden:
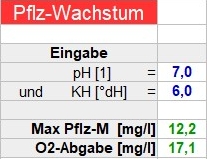
Pflz = fkt [pH, KH]
Das wird bei der Düngung der Wasserpflanzen vorgestellt und berechnet werden.

Pflz = fkt [pH, KH]

Das wird bei der Düngung der Wasserpflanzen vorgestellt und berechnet werden.

Neumünster, 30.07.2023 *
Egbert W Gerlich *
egbert@ew-gerlich.de